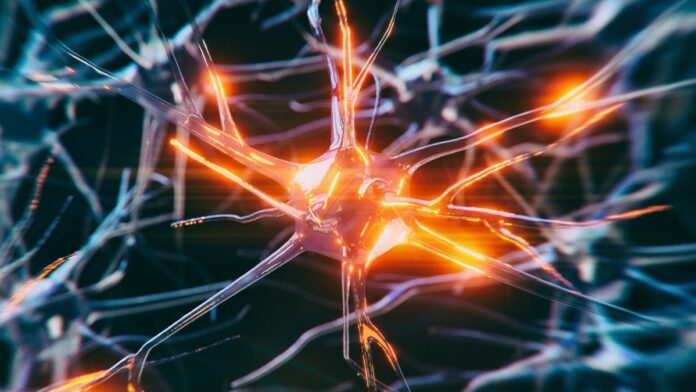
Деякі мозкові клітини стійкі до деменції: вчені виявили захисні механізми
Дослідники виявили конкретні клітинні процеси, що дозволяють деяким мозковим клітинам протистояти токсичному накопиченню білків, пов’язаних з хворобою Альцгеймера та іншими формами деменції. Це відкриття, нещодавно опубліковане групами вчених з UCLA Health і UC San Francisco викликають захворювання мутацій.
Роль тау-білків у нейродегенерації
Нейродегенеративні захворювання, включаючи хворобу Альцгеймера, часто зумовлені агрегацією неправильно згорнутих білків, зокрема тау. У той час як функціональні тау-білки необхідні для структури мозку та транспорту поживних речовин, їх аномальне скупчення порушує клітинну функцію та призводить до загибелі нейронів. Ступінь накопичення тау прямо корелює з прогресуванням нейродегенеративних станів.
У цьому дослідженні використовувалися вирощені в лабораторії людські нейрони, що містять мутацію, що викликає захворювання, (MAPT V337M), щоб більш точно відтворити умови людської хвороби, ніж у попередніх дослідженнях. Команда використовувала CRISPR-скринінг для систематичного відключення майже кожного гена в геномі людини, спостерігаючи, як кожна зміна впливала на скупчення тау-білка.
CRL5SOCS4: клітинна “група реагування на НС”
Скринінг виявив ключовий білковий комплекс CRL5SOCS4 як критично важливий для опору токсичному накопиченню тау. Цей комплекс діє як клітинна “група реагування на НС”, позначаючи неправильно згорнуті тау-білки для знищення протеасомами, системою утилізації відходів клітин.
Дослідники підтвердили ці висновки, проаналізувавши Атлас мозку хворих на хворобу Альцгеймера в Сіетлі, виявивши, що мозкові клітини з більш високою експресією CRL5SOCS4 демонстрували вищі показники виживання у померлих пацієнтів із хворобою Альцгеймера.
Мітохондріальна дисфункція та токсичність тау
Дослідження також виявило зв’язок між мітохондріальною дисфункцією та підвищеною токсичністю тау. Ушкоджені мітохондрії виробляють реактивний окислювальний стрес, який робить тау-білки більш схильними до скупчення. Клітини реагують, генеруючи фрагменти тау, які є біомаркером хвороби Альцгеймера в крові та спинномозковій рідині.
Цей зв’язок наголошує на важливості клітинного виробництва енергії для підтримки здоров’я мозку.
Терапевтичні перспективи
Результати вказують на два основні терапевтичні напрямки:
- Посилення активності CRL5SOCS4 для покращення очищення тау-білків. Це може включати розробку молекул, що зміцнюють взаємодію між CRL5SOCS4 та тау-білками.
- Захист протеасом від окислювального стресу, щоб забезпечити їх ефективну обробку тау до його накопичення.
Дослідники визнають, що багато шляхів, що контролюють рівні тау, залишаються неясними, але підкреслюють потенціал терапії, яка використовує природний захист організму від нейродегенерації.
Зрештою, це дослідження є важливим кроком до розуміння того, чому деякі мізки стійкі до деменції, відкриваючи нові можливості для цілеспрямованих втручань.