Las proteínas de membrana son esenciales para una amplia gama de procesos biológicos y representan una parte importante de los objetivos de los fármacos, lo que hace que su estudio sea increíblemente importante. Sin embargo, analizar estas proteínas ha sido históricamente difícil. Investigadores de los Institutos de Ciencias Físicas de Hefei, dirigidos por Wang Junfeng, han publicado un nuevo estudio en Analytical Chemistry que detalla una solución prometedora que mejora significativamente la confiabilidad del análisis de resonancia de plasmón superficial (SPR) de proteínas de membrana.
Por qué las proteínas de membrana son difíciles de estudiar
Aproximadamente un tercio de todas las proteínas humanas son proteínas de membrana y participan en funciones vitales como la señalización y el transporte celular. Casi el 60% de las proteínas a las que se dirigen los fármacos son proteínas de membrana. Esto resalta su papel clave en la salud y la enfermedad y, por lo tanto, subraya la necesidad de realizar estudios precisos.
Comprender cómo estas proteínas interactúan con otras moléculas (un proceso llamado unión) es crucial para desarrollar tratamientos eficaces. Una técnica llamada resonancia de plasmón superficial (SPR) proporciona una herramienta valiosa para hacerlo.
SPR se considera un “estándar de oro” en este campo porque permite a los científicos monitorear estas interacciones en tiempo real sin tener que etiquetar químicamente las proteínas. Sin embargo, un desafío importante ha sido encontrar formas confiables de inmovilizar (o unir) proteínas de membrana al chip sensor SPR preservando al mismo tiempo su estructura y función naturales. Si la forma o el comportamiento de la proteína cambian durante la unión, los resultados del análisis no son fiables.
Un enfoque novedoso: nanodiscos y SpyTag-SpyCatcher
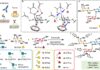
Para superar este desafío, el equipo de investigación desarrolló un nuevo método de inmovilización. Combinaron dos tecnologías establecidas: el sistema de conjugación covalente SpyCatcher-SpyTag y nanodiscos basados en proteínas de andamio de membrana (MSP), para crear un proceso simple, eficiente y estable.
Aquí hay un desglose del proceso:
- Creación de nanodiscos: El equipo diseñó una proteína de fusión que combina MSP con la molécula SpyTag. Esta proteína diseñada se utilizó luego para incorporar la proteína de membrana objetivo en nanodiscos. Los nanodiscos son pequeñas estructuras lipídicas artificiales que imitan el entorno donde normalmente residen las proteínas de membrana dentro de las membranas celulares.
- Adjunto específico: Estos nanodiscos llevan la etiqueta SpyTag. Luego, los investigadores preinmovilizaron proteínas SpyCatcher, que tienen una fuerte afinidad por SpyTag, en un chip sensor CM5 estándar utilizando un proceso de acoplamiento químico convencional.
- Inmovilización estable: Este diseño permite que los nanodiscos, que transportan la proteína de la membrana, sean capturados de manera específica y eficiente por las proteínas SpyCatcher. El resultado es una inmovilización robusta y estable de la proteína de membrana dentro de un entorno lipídico casi nativo, que esencialmente imita el entorno natural de la proteína.
Demostrando la eficacia del método
Para demostrar las capacidades del método, el equipo de investigación realizó un análisis SPR de tres tipos diferentes de interacciones de proteínas de membrana:
- Interacciones proteína-lípido
- Interacciones proteína transmembrana-anticuerpo
- Interacciones proteína transmembrana-molécula pequeña
Los resultados produjeron consistentemente datos SPR de alta calidad, lo que permitió una cuantificación precisa de la cinética de unión (qué tan rápido ocurren las interacciones) y las afinidades (con qué fuerza se unen las proteínas entre sí).
Importancia y potencial futuro
Este enfoque innovador aborda eficazmente las limitaciones de larga data de la tecnología SPR al estudiar proteínas de membrana. Al proporcionar un método confiable para la inmovilización, esta investigación tiene un potencial significativo para acelerar tanto la investigación de proteínas de membrana como los esfuerzos de descubrimiento de fármacos. Esta técnica debería conducir a una mayor comprensión del complejo papel de las proteínas de membrana y al desarrollo de terapias mejores y más específicas.