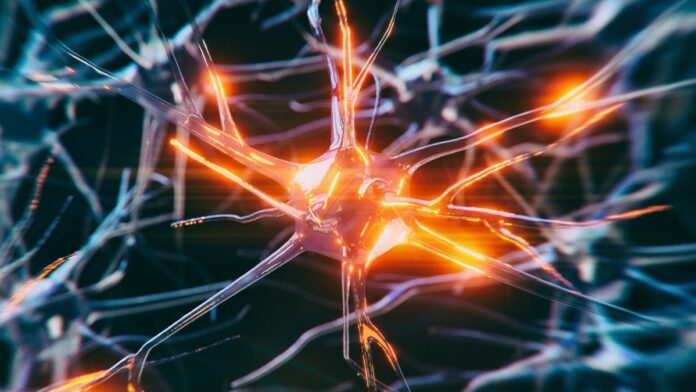
Výzkumníci identifikovali specifické buněčné procesy, které umožňují některým mozkovým buňkám odolat toxickému hromadění proteinů spojených s Alzheimerovou chorobou a jinými formami demence. Tento objev, nedávno zveřejněný týmy z UCLA Health a UC San Francisco, je důležitým krokem k pochopení toho, proč někteří lidé zůstávají kognitivně odolní, i když mají mutace způsobující onemocnění.
Role tau proteinů v neurodegeneraci
Neurodegenerativní onemocnění, včetně Alzheimerovy choroby, jsou často způsobena agregací špatně složených proteinů, zejména tau. Zatímco funkční proteiny tau jsou nezbytné pro strukturu mozku a transport živin, jejich abnormální akumulace narušuje buněčnou funkci a vede k smrti neuronů. Rozsah akumulace tau přímo koreluje s progresí neurodegenerativních stavů.
Tato studie používala laboratorně vypěstované lidské neurony obsahující mutaci způsobující onemocnění (MAPT V337M), aby přesněji replikovaly podmínky lidského onemocnění než předchozí studie. Tým použil screening CRISPR k systematickému vyřazení téměř každého genu v lidském genomu a sledoval, jak každá změna ovlivnila akumulaci proteinu tau.
CRL5SOCS4: celulární „tým nouzové reakce“
Screening identifikoval klíčový proteinový komplex, CRL5SOCS4, jako kritický pro odolávání toxické akumulaci tau. Tento komplex funguje jako buněčný „tým pro reakci na katastrofu“ a označuje špatně poskládané proteiny tau ke zničení proteazomem, buněčným systémem likvidace odpadu.
Vědci potvrdili tato zjištění analýzou atlasu mozku Alzheimerovy choroby v Seattlu a zjistili, že mozkové buňky s vyšší expresí CRL5SOCS4 vykazovaly vyšší míru přežití u zesnulých pacientů s Alzheimerovou chorobou.
Mitochondriální dysfunkce a toxicita tau
Studie také zjistila souvislost mezi mitochondriální dysfunkcí a zvýšenou toxicitou tau. Poškozené mitochondrie produkují reaktivní oxidační stres, díky kterému jsou tau proteiny náchylnější ke shlukování. Buňky reagují generováním tau fragmentů, které slouží jako biomarker Alzheimerovy choroby v krvi a mozkomíšním moku.
Toto spojení zdůrazňuje důležitost produkce buněčné energie pro udržení zdraví mozku.
Terapeutické perspektivy
Výsledky ukazují na dva hlavní terapeutické směry:
- Vylepšete CRL5SOCS4 pro zlepšení purifikace tau. To může zahrnovat vývoj molekul, které posilují interakci mezi CRL5SOCS4 a tau proteiny.
- Ochrana proteazomů před oxidačním stresem, aby bylo zajištěno, že efektivně zpracují tau dříve, než se nahromadí.
Vědci uznávají, že mnohé z cest, které kontrolují hladiny tau, zůstávají nejasné, ale zdůrazňují potenciál terapií, které využívají přirozenou obranu těla proti neurodegeneraci.
V konečném důsledku tato studie představuje důležitý krok k pochopení, proč jsou některé mozky odolné vůči demenci, a otevírá nové příležitosti pro cílené intervence.